
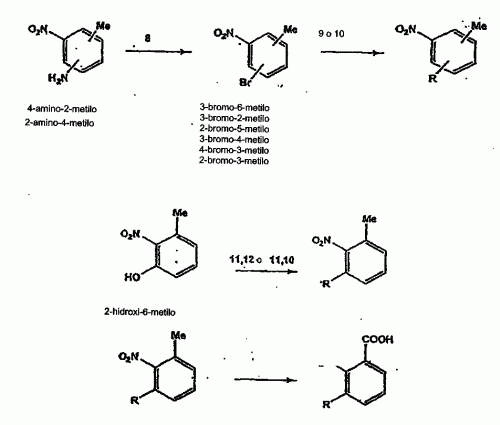
formación de alcoholes
hidrógeno.
Acidez y basicidad de los alcoholes
Los alcoholes son ácidos, el hidrógeno del grupo -OH tiene un pKa de 16.
Propiedades físicas
Los puntos de fusión y ebullición son elevados debido a la formación de puentes
Los alcoholes son ácidos, el hidrógeno del grupo -OH tiene un pKa de 16.
Propiedades físicas
Los puntos de fusión y ebullición son elevados debido a la formación de puentes
Oxidación de alcoholes
Formación de alcóxidos
Las bases fuertes los desprotonan los alcoholes formando alcóxidos. Pueden utilizarse organometálicos de litio o magnesio, LDA, hidruros de sodio e incluso sodio metal.
Las bases fuertes los desprotonan los alcoholes formando alcóxidos. Pueden utilizarse organometálicos de litio o magnesio, LDA, hidruros de sodio e incluso sodio metal.
Es necesario reconocer, que una reacción química sólo puede corresponder a un fenómeno químico que se verifique en condiciones adecuadas; es decir, no se debe proponer una reacción química inventada o que no sea una reacción real. Sin embargo, no siempre es posible predecir sí, al poner en contacto ciertas sustancias, se llevará a cabo la reacción o cuales serán los productora
las reacciones químicas se pueden clasificar en los siguientes tipos:
-De síntesis o
combinación
Es un
fenómeno químico, y a partir de dos o más sustancias se puede obtener otra (u
otras) con propiedades diferentes. Para que tenga lugar, debemos agregar las
sustancias a combinar en cantidades perfectamente definidas, y para producirse efectivamente la combinación
se necesitará liberar o absorber calor (intercambio de energía).
La
combinación del hidrógeno y el oxígeno para producir agua y la del hidrógeno y
nitrógeno para producir amoniaco son ejemplos
2H2 +
O2 —› 2 H2 O
formación de agua
3 H2
+ N2 —›
2 N H3 formación de amoníaco
De
descomposición
Es un
fenómeno químico, y a partir de una sustancia compuesta (formada por dos o más
átomos), puedo obtener dos o más sustancias con diferentes propiedades.

Ejemplos:
al
calentar óxido de mercurio, puedo obtener oxígeno y mercurio; se puede hacer
reaccionar el dicromato de amonio para obtener nitrógeno, óxido crómico y agua.
Para que se
produzca una combinación o una descomposición es fundamental que en el
transcurso de las mismas se libere o absorba energía, ya que sino, ninguna de
ellas se producirá. Al final de cualquiera de las dos tendremos sustancias distintas
a las originales. Y ha de observarse que no todas las sustancias pueden
combinarse entre sí, ni todas pueden ser descompuestas en otras.
De
sustitución o de reemplazo
En este caso
un elemento sustituye a otro en un compuesto
ejemplos:
ejemplos:
Zn +
2HCl ——› ZnCl2
+ H2
Mg + H2 SO4
——› Mg SO4 + H2
De doble
sustitución o de intercambio
En este tipo de reacciones se intercambian los
patrones de cada compuestos, ejemplo
2 CuOH +
H2SO4 ——› Cu2 SO4
+ 2H2O

Los principales métodos de obtención de
alcoholes son:
a) Hidratación de alquenos
Se trata de una reacción de adición electrófila, que esquemáticamente puede representarse mediante
Se trata de una reacción de adición electrófila, que esquemáticamente puede representarse mediante
La ecuación:
R—CH=CH2 + H2O
H2SO4
R—CHOH—CH3
R—CH=CH2 + H2O
H2SO4
R—CHOH—CH3
El grupo - OH se adiciona al átomo de carbono más sustituido del doble enlace. Por ello, éste es un método muy apropiado para la obtención de alcoholes secundarios y terciarios, algunos de los cuales se preparan así industrialmente a partir de las fracciones de olefinas procedentes del craqueo del petróleo. Asimismo, éste es el método industrial más importante de fabricación de alcohol etílico, por hidrogenación del etileno, CH2 = CH2 en presencia de ácido sulfúrico.
b) Hidrólisis de halogenuros de alquilo
b) Hidrólisis de halogenuros de alquilo
Se lleva a cabo normalmente en disolución de etanol acuoso y en presencia de catalizadores básicos, como KOH, AgOH, CO3Ca, etc.

R—CH2—Cl + AgOH
AgCl + R—CH2OH
AgCl + R—CH2OH
Esta reacción puede realizarse industrialmente con hidrógeno, en presencia de catalizadores, o bien en el laboratorio, mediante el hidruro de litio y aluminio, H4LiAl. Con aldehídos se obtienen alcoholes primarios y con cetonas alcoholes secundarios, según las siguientes
Ecuaciones:
d) Mediante reactivos de Grignard
La adición de un magnesiano o reactivo de Grignard a un compuesto carbonílico da lugar a un halogenuro de alcoximagnesio, que por hidrólisis conduce a un alcohol. Cuando se emplea formaldehído, H2C=O, como producto de partida, se obtiene un alcohol primario; con los restantes aldehídos se obtienen alcoholes secundarios y con las cetonas alcoholes terciarios.
e) Métodos especiales
Los dos primeros miembros de la serie de alcoholes alifáticos, metanol y etanol, se obtienen también por métodos especiales que conviene mencionar. El metanol se obtenía antiguamente por destilación seca de la madera, de donde procede el nombre de alcohol de madera con que a veces se le conoce. Modernamente, casi todo el metanol que se consume en la industria se obtiene por hidrogenación catalítica del monóxido de carbono
Según la reacción:
-CO + 2H2 CH3OH
Que se lleva a cabo a unos 400 °C y 200 atm, en presencia de catalizadores formados corrientemente por una mezcla de óxidos de cromo y de cinc. El alcohol metílico es muy venenoso. Por ello, el consumo humano de alcohol etílico para usos industriales, que está desnaturalizado con metanol produce graves lesiones en la vista, ceguera e incluso la muerte.
El etanol (alcohol del vino) se ha venido produciendo desde la antigüedad por fermentación de los azúcares (como glucosa), contenidos en jugos de frutos, para la fabricación de bebidas alcohólicas. La fermentación se produce por la acción de enzimas (o fermentos), que son catalizadores orgánicos complejos segregados por las células de levaduras, obteniéndose, como productos finales, etanol y CO2.
según la reacción global:
C 6H12 06
2CO2 + 2CH3—CH2 OH

No hay comentarios :
Publicar un comentario