

Las Reacciones Químicas
Las reacciones químicas son procesos en los que una o más sustancias se transforman en otra u otras con propiedades diferentes. Para que pueda existir una reacción química deben haber sustancias que reaccionan y sustancias que se forman. Se denominará reaccionante o reactivo a la sustancia química que reacciona. A las sustancias que se generan debido a una reacción química se les denomina sustancia resultante o producto químico. Los cambios químicos alteran la estructura interna de las sustancias reaccionantes.
Generalmente, se puede decir que ha ocurrido una reacción si se observa que al interactuar los "supuestos" reaccionantes se da la formación de un precipitado, algún cambio de temperatura, formación de algún gas, cambio de olor o cambio de color durante la reacción.
A fin de expresar matemática una reacción química se hace necesario utilizar una expresión en la cual se señalan los reactivos y los productos. Esta expresión recibe el nombre de ecuación química.
Existen cuatro tipos de reacciones:
a) Combinación
b) Descomposición
c) Desplazamiento
d) Doble combinación
Las reacciones también pueden ser clasificadas en
a)Reacción química homogéneas b)Reacción química heterogénea.
El estudio de la rapidez con la que se efectúa una reacción química, consumiendo reaccionantes químicos y liberando productos químicos, se denomina cinética química. Se puede expresar la rapidez de reacción como la relación que se presenta entra la masa de reaccionante consumida y tiempo que dura la reacción. También se puede tomar la rapidez de reacción como la relación existente entre la masa formada de producto y el tiempo de reacción.
Al analizar una reacción química es muy importante tener en cuenta la ley de la conservación de la masa. Esto quiere decir, que, en toda reacción química la masa total de las sustancias químicas reaccionantes tiene que ser igual a la masa total de los productos químicos. Efectivamente, la ley de la conservación de la masa establece que la materia no se crea ni se destruye, sólo se transforma.
Otro aspecto que se debe tomar en cuenta al analizar las reacciones química es que en una reacción química las sustancias reaccionan en proporciones fijas de masa. El químico francés Joseph Louis Prost enunció este fenómeno de la siguiente manera:"Cuando dos o más elementos se combinan para formar un compuesto, lo hacen en una relación fija de masa". Este principio en el comportamiento de la reacción química trae como consecuencia que, como las sustancias químicas siempre reaccionan en la misma proporción, si uno de los reaccionantes se encuentra en exceso con respecto al otro, el exceso no participará en la reacción
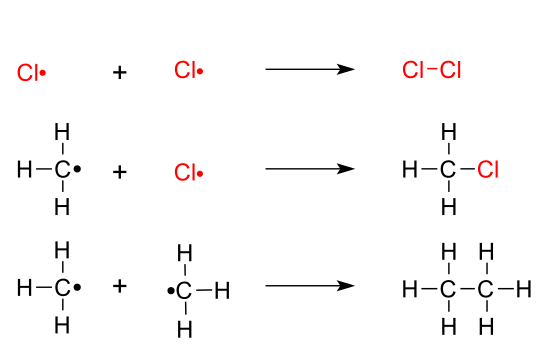
Reacción de alcanos con halógenos
Los alcanos reaccionan con halógenos mediante mecanismos radicalarias. Dicha reacción supone la sustitución de uno o varios hidrógenos del alcano por halógenos.
Los alcanos reaccionan con halógenos mediante mecanismos radicalarias. Dicha reacción supone la sustitución de uno o varios hidrógenos del alcano por halógenos.
Mecanismo de la halogenación radicalaria
El mecanismo de la halogenación radicalaria consta de tres etapas: iniciación, propagación y terminación. En la iniciación la molécula de halógeno rompe de forma homolítica generando radicales. En la etapa de propagación se produce la sustitución de hidrógenos del alcano por halógenos. Cuando los reactivos se agotan, los radicales que hay en el medio se unen entre si, produciéndose la etapa de terminación.
El mecanismo de la halogenación radicalaria consta de tres etapas: iniciación, propagación y terminación. En la iniciación la molécula de halógeno rompe de forma homolítica generando radicales. En la etapa de propagación se produce la sustitución de hidrógenos del alcano por halógenos. Cuando los reactivos se agotan, los radicales que hay en el medio se unen entre si, produciéndose la etapa de terminación.
Reactividad de los halógenos
La primera etapa de propagación determina la velocidad de la reacción. Para el flúor esta etapa es de baja energía de activación lo que convierte al flúor en el halógeno mas reactivo. En el caso del yodo la energía de activación es muy elevada y la reacción no se produce. Orden de reactividad en reacciones radicalarias: F2>Cl2>Br2>I2 En resumen, el yodo no es reactivo en la halogenación radicalaria y el flúor reacciona de forma violenta.
La primera etapa de propagación determina la velocidad de la reacción. Para el flúor esta etapa es de baja energía de activación lo que convierte al flúor en el halógeno mas reactivo. En el caso del yodo la energía de activación es muy elevada y la reacción no se produce. Orden de reactividad en reacciones radicalarias: F2>Cl2>Br2>I2 En resumen, el yodo no es reactivo en la halogenación radicalaria y el flúor reacciona de forma violenta.

Tipos de Reacciones Químicas:
Las
reacciones químicas pueden clasificarse de manera sencilla en cinco grandes
grupos. Existen otras clasificaciones, pero para predicción de los
productos de una reacción, esta clasificación es la más útil.

No hay comentarios :
Publicar un comentario