Contenidos
hacerlo. O sustituimos un hidrógeno por el grupo –OH , generando un alcohol (R-OH ), o colocamos el
oxígeno entre dos átomos de carbono y obtenemos el grupo funcional éter (R-O-R ).
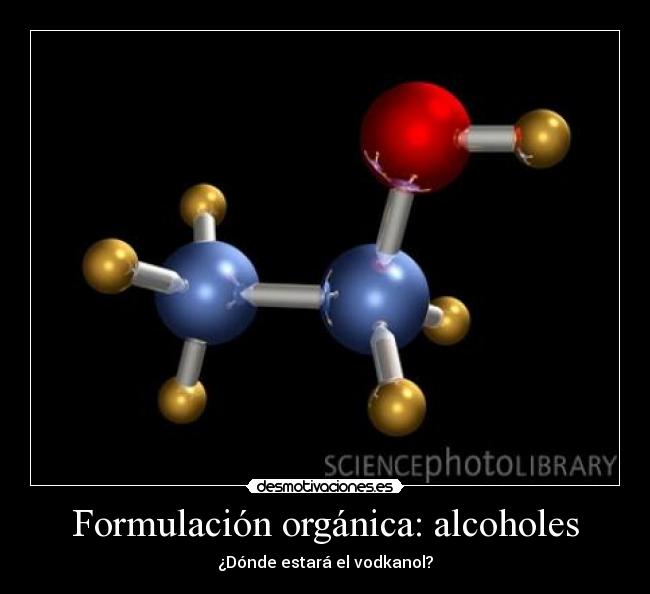
ALCOHOLES.
Son compuestos que resultan de la sustitució n de átomos de hidrógeno de los
hidrocarburos por grupos hidroxilos ( -OH).

Clasificación
1.- Según la ubicación del grupo funcional:
a) Alcoholes primarios son aquellos en que el -OH va unido a un carbono primario:
H
|
R-C-O-H alcohol primario
|
H
b ) Alcoholes secundarios son aquellos en que el -OH va unido a un carbono secundario:
I. H
|
R-C-O-H alcohol secundario
|
R’
e) Alcoholes terciarios son los que llevan el -OH unido a un carbono terciario:
R’
|
R’’-C-O-H
|
|
R’’-C-O-H
|
Monoles
Son los alcoholes que poseen un solo grupo funcional. A continuación se da una lista de los
primeros términos.
primeros términos.
CH3OH metanol alcohol metílico
CH3-CH2OH etanol alcohol etílico
CH3-CH2-CH2OH 1 -propanol alcohol propílico normal
CH3-CHOH-CH3 2-propanol alcohol isopropílico
CH3-CH2-CH2-CH2OH 1-butanol alcohol butílico normal
CH3-CHOH-CH2-CH3 2-butanol alcohol butílico secundario
CH3-CH-CH2OH
| 2-metil-1-propanol alcohol isobutílico
CH3
CH3
|
CH3-C-OH 2-metil-2-propanol alcohol butílico terciario
|
CH3
CH3-CH2-CH2-CH2-CH2OH 1-pentanol alcohol amílico
Dioles
Son los alcoholes que poseen dos grupos funcionales. Se nombran con el nombre del hidrocarburo respectivo terminado en diol. También se les llama glicoles.
CH2OH CH2OH CH2OH
| | |
CH2OH CHOH CH2
| |
CH3 CH2OH
etanodiol 1,2 propanodiol 1,3 propanodiol
Glicol ordinario propilenglicol trimetilenglicol
| | |
CH2OH CHOH CH2
| |
CH3 CH2OH
etanodiol 1,2 propanodiol 1,3 propanodiol
Glicol ordinario propilenglicol trimetilenglicol
Trioles
Son los alcoholes que llevan tres grupos hidroxilos. Su nombre se compone del nombre del
hidrocarburo y la terminación triol. El más importante es la glicerina.
CH2OH
|
CHOH propanotriol, glicerina, glicerol
|
CH20H
Polioles
hidrocarburo y la terminación triol. El más importante es la glicerina.
CH2OH
|
CHOH propanotriol, glicerina, glicerol
|
CH20H
Polioles

Son los alcoholes que poseen varios grupos OH:
CH2OH - CHOH - CHOH - CH2OH eritrita, eritrol, butanotetrol
CH2OH - CHOH - CHOH - CHOH - CH2OH arabita, xilita, pentanopentol
CH2OH - CHOH - CHOH - CHOH - CHOH - CH2OH sorbita, dulcita, manita, hexanohexol

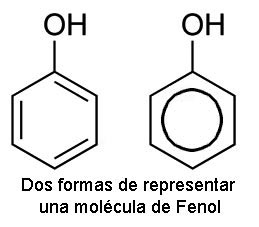
FENOLES
Son compuestos hidroxilados en que el grupo funcional va unido a un carbono que forma parte
de un anillo aromático. El representante más típico es el fenol ordinario o ácido fénico, derivado del
benceno.
de un anillo aromático. El representante más típico es el fenol ordinario o ácido fénico, derivado del
benceno.
Fenodioles. Son los fenoles que poseen dos grupos funcionales OH. Son tres isómeros, orto, meta y para
fenodiol, conocidos también como pirocatequina, resorcina e hidroquinona, respectivamente
fenodiol, conocidos también como pirocatequina, resorcina e hidroquinona, respectivamente

Nomenclatura
Para nombrar los alcoholes tenemos dos alternativas:
1. Añadir el sufijo -ol al nombre del hidrocarburo de referencia (p.ej.: propanol)
2. Citar primero la función (alcohol) y luego el radical (p.ej.: alcohol propílico)
En compuestos ramificados el nombre del alcohol deriva de la cadena más larga que contenga el grupo
-OH.
Al numerar la cadena se asigna al C unido al -OH el localizador más bajo posible.
Cuando el grupo -OH interviene como sustituyente se utiliza el prefijo -hidroxi.
En alcoholes cíclicos el carbono unido al -OH ocupa siempre la posición 1.
1. Añadir el sufijo -ol al nombre del hidrocarburo de referencia (p.ej.: propanol)
2. Citar primero la función (alcohol) y luego el radical (p.ej.: alcohol propílico)
En compuestos ramificados el nombre del alcohol deriva de la cadena más larga que contenga el grupo
-OH.
Al numerar la cadena se asigna al C unido al -OH el localizador más bajo posible.
Cuando el grupo -OH interviene como sustituyente se utiliza el prefijo -hidroxi.
En alcoholes cíclicos el carbono unido al -OH ocupa siempre la posición 1.
Propiedades químicas de los alcoholes
1.- Formación de alcóxidos. El hidrógeno del grupo funcional es reemplazable por metales como Na, K,
Ca, formándose alcoholatos o alcóxidos. En esta propiedad los alcoholes se parecen a los ácidos.
2 CH3OH + 2 Na ---> 2 CH3ONa + H2
metilato sódico o
metóxido de sodio
Ar-OH + NaOH ---> Ar-ONa + H2O
Fenóxido de sodio
Ar-OH + NaOH ---> Ar-ONa + H2O
Fenóxido de sodio
2.- Formación de ésteres. Se combinan con los ácidos produciendo ésteres.
CH3-CH2OH + CH3-COOH--> H2O + CH3-COO-CH2-CH3
3.- Deshidratación. En presencia de agentes deshidratantes, como el ácido sulfúrico concentrado,
producen alquenos o éteres, según la temperatura. A 140ºC se produce un éter
2 CH3-CH2OH---> CH3-CH2-O-CH2-CH3 + H2O
a 180ºC se obtiene un alqueno
CH3−CH2OH ---> CH2 CH2 + H2O
4.- Oxidación. Los primeros términos de la serie se oxidan con facilidad. El producto formado depende de la
clase de alcohol
a) los alcoholes primarios por oxidación débil producen un aldehído y si la acción oxidante es más enérgica
producen un ácido


















.GIF)